Como Se Classificam Os Sais Em Que Consistem De Exemplos – Como Se Classificam Os Sais: Definição, Tipos e Exemplos, é um tópico fundamental na química, que nos ajuda a compreender a estrutura e as propriedades de uma classe de compostos amplamente utilizados em diversas áreas. Sais são compostos iônicos formados pela reação de neutralização entre um ácido e uma base, resultando na formação de um cátion e um ânion.
A classificação de sais é crucial para a compreensão de suas reações químicas, aplicações e propriedades, permitindo que os químicos prevejam seu comportamento e explorem suas diversas funcionalidades.
Neste estudo, exploraremos a classificação de sais com base na natureza do ânion e do cátion, examinando os principais tipos de sais, suas características e exemplos específicos. Abordaremos também as reações de formação de sais, as propriedades físicas e químicas que os distinguem e suas aplicações em áreas como indústria, saúde e agricultura.
Através desta análise, obteremos uma visão abrangente da importância dos sais e de como sua classificação facilita a compreensão de suas propriedades e usos.
Introdução à Classificação de Sais: Como Se Classificam Os Sais Em Que Consistem De Exemplos
Os sais são compostos iônicos formados pela reação de um ácido com uma base, resultando na neutralização de suas propriedades. A classificação de sais é fundamental para a compreensão de suas propriedades químicas e físicas, bem como para a previsão de suas aplicações em diferentes áreas, como indústria, saúde e agricultura.
Tipos de Sais

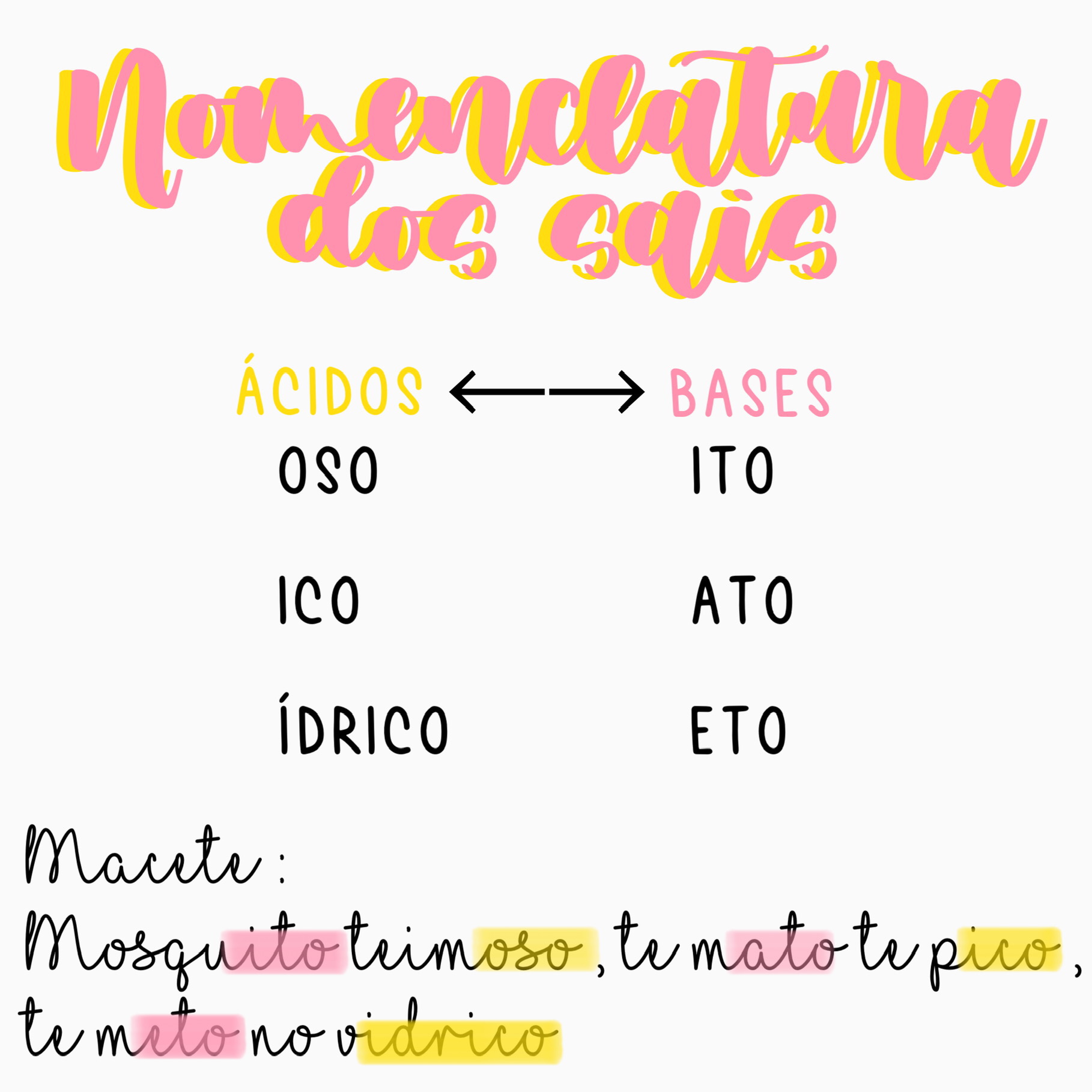
Os sais podem ser classificados de acordo com diferentes critérios, sendo os mais comuns a natureza do ânion e do cátion.
- Sais neutros:Formados pela reação completa de um ácido forte com uma base forte. Exemplos: NaCl (cloreto de sódio), KBr (brometo de potássio).
- Sais ácidos:Formados pela reação incompleta de um ácido forte com uma base fraca. Possuem íons hidrogênio (H+) em sua estrutura. Exemplos: NaHSO4 (sulfato ácido de sódio), KHCO3 (bicarbonato de potássio).
- Sais básicos:Formados pela reação incompleta de um ácido fraco com uma base forte. Possuem íons hidroxila (OH-) em sua estrutura. Exemplos: Ca(OH)Cl (cloreto de cálcio básico), Mg(OH)NO3 (nitrato de magnésio básico).
Classificação de Sais com Base na Natureza do Ânion
Os ânions são íons carregados negativamente que compõem os sais. A natureza do ânion determina a classificação do sal e suas propriedades químicas. Os principais ânions que formam sais são:
Ânions Comuns e Classificação de Sais
| Ânion | Nome do Sal | Exemplos |
|---|---|---|
| Cl- (cloreto) | Cloreto | NaCl (cloreto de sódio), KCl (cloreto de potássio) |
| Br- (brometo) | Brometo | KBr (brometo de potássio), NaBr (brometo de sódio) |
| I- (iodeto) | Iodeto | KI (iodeto de potássio), NaI (iodeto de sódio) |
| SO42- (sulfato) | Sulfato | Na2SO4 (sulfato de sódio), K2SO4 (sulfato de potássio) |
| NO3- (nitrato) | Nitrato | KNO3 (nitrato de potássio), NaNO3 (nitrato de sódio) |
| CO32- (carbonato) | Carbonato | Na2CO3 (carbonato de sódio), K2CO3 (carbonato de potássio) |
| PO43- (fosfato) | Fosfato | Na3PO4 (fosfato de sódio), K3PO4 (fosfato de potássio) |
Classificação de Sais com Base na Natureza do Cátion
Os cátions são íons carregados positivamente que também compõem os sais. A natureza do cátion influencia as propriedades químicas e físicas do sal, como solubilidade, ponto de fusão e ponto de ebulição.
Cátions Comuns e Propriedades dos Sais
- Cátions de metais alcalinos (Li+, Na+, K+, Rb+, Cs+):Formam sais geralmente solúveis em água, com pontos de fusão e ebulição relativamente baixos. Exemplos: NaCl (cloreto de sódio), KCl (cloreto de potássio).
- Cátions de metais alcalino-terrosos (Be2+, Mg2+, Ca2+, Sr2+, Ba2+):Formam sais menos solúveis em água do que os sais de metais alcalinos, com pontos de fusão e ebulição mais altos. Exemplos: CaCO3 (carbonato de cálcio), MgCl2 (cloreto de magnésio).
- Cátions de metais de transição (Fe2+, Cu2+, Zn2+, Ni2+):Formam sais com uma variedade de solubilidades e propriedades físicas, dependendo do metal específico. Exemplos: FeCl3 (cloreto de ferro III), CuSO4 (sulfato de cobre II).
- Cátions de amônio (NH4+):Formam sais geralmente solúveis em água, com propriedades químicas semelhantes aos sais de metais alcalinos. Exemplos: NH4Cl (cloreto de amônio), (NH4)2SO4 (sulfato de amônio).
Exemplos de Sais e suas Aplicações
Os sais têm uma ampla gama de aplicações em diferentes áreas, como indústria, saúde e agricultura. A aplicação específica de um sal depende de suas propriedades químicas e físicas.
Aplicações de Sais
| Nome do Sal | Fórmula Química | Aplicações | Exemplo de Uso |
|---|---|---|---|
| Cloreto de Sódio (NaCl) | NaCl | Conservante de alimentos, tempero, produção de cloro e soda cáustica | Sal de cozinha, produção de sabão |
| Sulfato de Cobre II (CuSO4) | CuSO4 | Fungicida, tratamento de água, produção de corantes | Controle de fungos em plantações, tratamento de água potável |
| Carbonato de Cálcio (CaCO3) | CaCO3 | Material de construção, suplemento de cálcio, produção de cimento | Pedra calcária, antiácido estomacal |
| Nitrato de Potássio (KNO3) | KNO3 | Fertilizante, conservante de alimentos, produção de pólvora | Adubo para plantas, conservante de carnes |
Reações de Formação de Sais
Os sais são formados por diferentes tipos de reações químicas, incluindo reações de neutralização, reações de dupla troca e reações de decomposição.
Tipos de Reações de Formação de Sais
- Reações de Neutralização:Um ácido reage com uma base, formando sal e água.
Exemplo: HCl (ácido clorídrico) + NaOH (hidróxido de sódio) → NaCl (cloreto de sódio) + H2O (água)
- Reações de Dupla Troca:Dois reagentes iônicos trocam seus íons, formando dois novos compostos, um dos quais é um sal.
Exemplo: AgNO3 (nitrato de prata) + NaCl (cloreto de sódio) → AgCl (cloreto de prata) + NaNO3 (nitrato de sódio)
- Reações de Decomposição:Um composto se decompõe em dois ou mais produtos, um dos quais é um sal.
Exemplo: CaCO3 (carbonato de cálcio) → CaO (óxido de cálcio) + CO2 (dióxido de carbono)
Propriedades dos Sais
Os sais possuem uma variedade de propriedades físicas e químicas, como solubilidade, ponto de fusão, ponto de ebulição e condutividade elétrica. Essas propriedades são influenciadas pela natureza do cátion e do ânion que compõem o sal.

