Éteres e Ésteres: Uma Comparação Detalhada: Diferençie O Grupo De Eter E Ester Com Exemplos Braylin
Diferençie O Grupo De Eter E Ester Com Exemplos Braylin – Éteres e ésteres são duas classes importantes de compostos orgânicos que, apesar de apresentarem semelhanças em suas estruturas, possuem propriedades e aplicações distintas. Compreender suas diferenças estruturais e funcionais é crucial para a compreensão da química orgânica. Esta análise comparativa explorará as características fundamentais de cada grupo, destacando suas peculiaridades e aplicações no mundo da química.
Introdução: Éteres e Ésteres – Conceitos Básicos
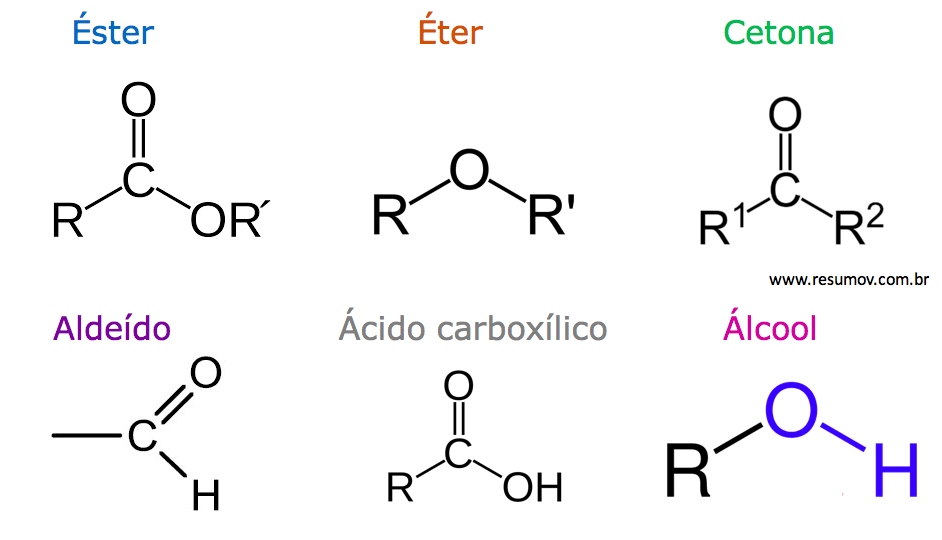
Éteres são compostos orgânicos caracterizados pela presença de um átomo de oxigênio ligado a dois grupos alquila ou arila (R-O-R’). Já os ésteres são derivados de ácidos carboxílicos, onde o grupo hidroxila (-OH) é substituído por um grupo alcoxila (-OR). A principal diferença estrutural reside na presença do grupo carbonila (C=O) nos ésteres, ausente nos éteres.
A fórmula geral para éteres é R-O-R’, enquanto a fórmula geral para ésteres é RCOOR’, onde R e R’ representam grupos alquila ou arila. O éter dietílico, por exemplo, tem a fórmula CH 3CH 2-O-CH 2CH 3, enquanto o acetato de etila possui a fórmula CH 3COOCH 2CH 3. A nomenclatura IUPAC para éteres segue a ordem alfabética dos grupos alquila, seguida da palavra “éter”.
Para ésteres, o nome é derivado do ácido carboxílico e do álcool correspondentes, substituindo o sufixo “-óico” do ácido por “-ato”.
Diferenças Estruturais e de Ligação
A ligação éter é uma ligação simples C-O-C, enquanto a ligação éster envolve uma ligação simples C-O e uma ligação dupla C=O (grupo carbonila). A presença do grupo carbonila nos ésteres confere maior polaridade e reatividade em comparação aos éteres. A polaridade do grupo carbonila influencia diretamente as propriedades dos ésteres, afetando sua solubilidade em água e seus pontos de ebulição.
Éteres geralmente apresentam menor polaridade que ésteres de massa molar similar, devido à ausência do grupo carbonila. Consequentemente, éteres tendem a ser menos solúveis em água do que ésteres comparáveis.
| Característica | Éter | Éster | Exemplo |
|---|---|---|---|
| Ligação | C-O-C | C-O-C=O | – |
| Grupo Carbonila | Ausente | Presente | – |
| Polaridade | Baixa | Alta | – |
| Solubilidade em água | Geralmente baixa | Geralmente maior que éteres | Éter dietílico (baixa) vs. Acetato de etila (moderada) |
Propriedades Físicas e Químicas
Éteres e ésteres de massas molares semelhantes apresentam pontos de ebulição diferentes devido às suas polaridades distintas. Ésteres, por possuírem o grupo carbonila, apresentam pontos de ebulição mais altos que éteres devido às interações intermoleculares mais fortes (dipolo-dipolo). A reatividade também difere significativamente. Éteres são relativamente inertes, enquanto ésteres são mais reativos, sofrendo reações como hidrólise e transesterificação.
- Éter dietílico: Ponto de ebulição baixo (34,6 °C), densidade baixa, baixa solubilidade em água.
- Tetrahidrofurano (THF): Ponto de ebulição moderado (66 °C), densidade moderada, miscível em água.
- Anisol: Ponto de ebulição moderado (154 °C), densidade moderada, baixa solubilidade em água.
- Acetato de etila: Ponto de ebulição moderado (77 °C), densidade baixa, moderada solubilidade em água.
- Benzoato de metila: Ponto de ebulição alto (199 °C), densidade moderada, baixa solubilidade em água.
- Butanoato de etila: Ponto de ebulição moderado (120 °C), densidade baixa, baixa solubilidade em água.
Exemplos e Aplicações, Diferençie O Grupo De Eter E Ester Com Exemplos Braylin
Éteres e ésteres encontram amplas aplicações na indústria e na vida cotidiana. Os éteres são utilizados como solventes, anestésicos e intermediários em síntese orgânica, enquanto os ésteres são encontrados em aromas, fragrâncias, plásticos e como solventes.
| Composto | Fórmula Estrutural | Aplicações |
|---|---|---|
| Éter dietílico | CH3CH2OCH2CH3 | Solvente, anestésico |
| Tetrahidrofurano (THF) | (CH2)4O | Solvente em síntese orgânica |
| Anisol | C6H5OCH3 | Fragrância, solvente |
| Acetato de etila | CH3COOCH2CH3 | Solvente, removedor de esmalte |
| Benzoato de metila | C6H5COOCH3 | Fragrância (bálsamo de tolu) |
O acetato de etila, por exemplo, é um solvente excelente devido à sua volatilidade, baixa polaridade e capacidade de dissolver uma ampla gama de compostos orgânicos. Sua baixa toxicidade e fácil remoção também contribuem para sua popularidade como solvente.
Reações Químicas: Síntese e Degradação
A síntese de éteres pode ser realizada através de reações de desidratação de álcoois ou por alquilação de alcóxidos. A síntese de ésteres, por sua vez, é frequentemente realizada através da esterificação de Fischer, uma reação de equilíbrio entre um ácido carboxílico e um álcool na presença de um catalisador ácido. A hidrólise de ésteres, que é a reação inversa da esterificação, pode ocorrer em meio ácido ou básico, resultando na formação de um ácido carboxílico e um álcool.
A hidrólise ácida é um processo reversível, enquanto a hidrólise básica é irreversível.
Quais são as principais reações de degradação dos ésteres?
As principais reações de degradação dos ésteres são as hidrólises ácida e básica (saponificação), que resultam na formação de um ácido carboxílico e um álcool.
Existem éteres cíclicos?
Sim, existem éteres cíclicos, como o epóxido (oxirano), um éter cíclico de três membros, e o tetrahidrofurano (THF), um éter cíclico de cinco membros, ambos com importantes aplicações.
Como a massa molar influencia as propriedades físicas de éteres e ésteres?
A massa molar influencia diretamente propriedades como o ponto de ebulição. Compostos de maior massa molar geralmente apresentam pontos de ebulição mais elevados devido às maiores forças intermoleculares.

